2.シナプス分子検出における問題点


1992年、北海道大学医学部解剖学教室の助教授として赴任するやすぐに取りかかったのが、アイソトープ標識プローブによるイオンチャネル型グルタミン酸受容体のin situハイブリダイゼーションの立ち上げと、大腸菌による融合タンパク質*1の発現によるグルタミン酸受容体抗体作成とそれを用いた免疫組織化学である。まず、前半でこの2つの組織化学法の解析技術について解説し、後半でグルタミン酸シグナル伝達系という自身の研究テーマの推進とそこで出会った問題点について触れることにする。
前回、35S-dATP標識のcDNAプローブに2-メルカプトエタノールの添加を契機として、in situハイブリダイゼーションの基本技術が一気に確立したことを話した。その後、この解析技術はどんどん進化していった。
まず、使用できる放射性核種は半減期のより短いもの(3H→35S→33P)が使用できるようになり、検出にかかる時間が短縮した。当初、ニックトランスレーションによる二本鎖DNAプローブだったものが、相補的な合成オリゴヌクレオチド*2やcRNA*3転写物による一本鎖プローブへと移行した。これにより、二本鎖DNA間のハイブリッド形成によるプローブの有効濃度の低下が解消されて検出感度が増大し、安定的にシグナルを検出できるようになった。従来の感光乳剤をスライドグラスに塗布するミクロオートラジオグラフィーに加え、X線フィルムにスライドグラスを密着してシグナルを検出するマクロオートラジオグラフィーも普及し、発現解析のスピードアップとともに時間的・空間的な発現変化を捉えやすくなった(Watanabe et al., 1992)。また、digoxygenin, fluorescein, biotinなどの非放射性標識cRNAプローブによる検出技術の改善により、今では放射性プローブを凌駕する特異性と感度を備えた発色性および蛍光性の検出技術へと進化した。特に、蛍光検出法により、細胞マーカーと目的遺伝子の多重標識が可能になり、発現細胞の特定や関連遺伝子の共発現情報も容易に得られるようになり、組織化学法としての有用性を倍加した(Yamasaki et al., 2010,2011; Konno et al., 2014)。さらに、RNAscope™という増感系の新しいin situハイブリダイゼーションが開発され、驚くほど高感度でノイズの低い検出も実現している。
現在の生命科学研究は、シングルセルRNA解析*4やVisium*5空間トランスクリプトーム解析などによるオミックス研究が全盛期を向かえ、情報科学の研究分野へと発展している。最終的に細胞レベルでの発現を最終的に確定できるin situハイブリダイゼーションの有用性は、情報科学の進展に従ってより一層増大している。
特異的な一次抗体と標識二次抗体を用いた免疫組織化学は、タンパク質分子の発現と局在を確定する重要な組織化学であり、抗原を有する細胞の形態を観察する方法として最も汎用性に富む研究手法である(脳科学辞典2014)。標識物質(レポーター分子)が蛍光物質であれば多重検出が可能な蛍光抗体法*6となり、酵素であれば酵素抗体法*7としてシグナルを増幅して検出できる。標識物質が重金属であれば電子顕微鏡で観察できる免疫電顕法となる。免疫電顕法には、樹脂包埋前に免疫反応を行う包埋前免疫電顕法*8と、樹脂切片に対して免疫反応を行う包埋後免疫電顕法*9があり、それぞれ相補うような長所と短所がある。
In situハイブリダイゼーションと免疫組織化学を比較すると、検出シグナルの特異性と信頼性は圧倒的に前者に軍配があがる。核酸の塩基配列の相補性を基盤とするin situハイブリダイゼーションのシグナル特異性は、反応液や洗浄液の塩濃度と温度*10という2つの物理化学的パラメーターによりコントロールできる。きちんと確立した1つのプロトコールを習熟することで、数多くの遺伝子の特異的シグナルを確実に得ることができる。もし、塩基配列の相同性の高いホモローグ*11が存在したとしても、ゲノムの全容解明が進んだ現在では、プローブ配列への留意と選択さえ怠らなければ特異的検出は可能である。極論すれば、in situハイブリダイゼーションができない唯一のことは、遺伝子発現レベルがその方法の検出限界以下の場合だけである。
これに対して、抗原抗体反応を原理とする免疫組織化学の特異性は、使用する一次抗体の良し悪しや研究者自身に依存する要素が高く、しばしば異なる結果と結論が出てくる。免疫組織化学による研究成果は、ある意味で研究者としての生き方や姿勢を反映していると、私は思っている。要するに、免疫組織化学は平気で嘘をつくのである。それは、抗体が相互作用する抗原の数アミノ酸残基(抗原決定基)との間の静電力、ファンデルワールス力、水素結合等の総和による親和性や結合力は、固定剤や変性剤の使用や選択、抗体濃度、塩濃度、pHなどの諸条件で変化する。そのよい例が、イムノブロットで使える抗体が免疫組織化学に使えなかったり、その逆のケースもある。この2つの解析法ではタンパク質の固定や変性に使用する試薬が異なり、共有結合する位置も異なり、それゆえ抗原決定基の立体構造に与える影響も異なり、抗体と抗原の間の親和性や結合力が変動するのは当然である。その結果、ホモローグでもない全く予想外の分子とも相互作用することがあり、いわゆる非特異反応が生じる。そのような非特異反応が生じうる免疫組織化学とどう向き合うのか、特異性と非特異性の境界を見分けようとするのかしないのか、これが研究者としての生き方や姿勢を反映するという意味である。
1992年の北大赴任が31才の時で、「免疫組織化学が容易に嘘をつく」とか、「免疫組織化学は研究者としての生き方や姿勢を反映する」という認識は、未だ醸成されていなかった。前回触れた新潟大学脳研究所への国内留学をキッカケとしてグルタミン酸シナプス伝達研究に足を踏み入れ、北大に来てイケイケドンドンの気持ちで研究を立ち上げたのである。
その年は、NMDA型グルタミン酸受容体の機能的多様性を作り出す4種のGluN2サブユニット遺伝子が三品研から発表された記念すべき年である。それに追いつくべく、片方の腕でNMDA受容体サブユニットのin situハイブリダイゼーション解析を行い、毎月数百枚のスライドグラスのオートラジオグラフィーメモを仕込んでは論文にしていった。もう一方の腕は、それまでやったことのない大腸菌を用いた融合タンパク質発現の条件検討を行い、さまざまな発現系の中から、グルタチオンS転移酵素*12を融合タンパクとしその切断にトロンビン*13を用いるpGEX4Tプラスミド実験系を選んだ。その理由は、発現させた時に可溶性タンパク質になりやすいこと、グルタチオンセファロースカラム*14で免疫用抗原と抗体アフィニティー精製用のタンパク質の両方を1回の実験で簡便に精製できること、トロンビンを安価で購入できること、が主な理由であった。以来30年以上に渡りこの融合タンパクを用いて抗体作成を続け、ニットーボーメディカルの研究用抗体として販売している抗体のほとんどが、この方法で作成したものである。具体的な作成法については、このシリーズの最後の方で説明する予定である。
ところが、NMDA型グルタミン酸受容体の主要なサブユニットの免疫組織化学論文を出せたのは1998年である(Watanabe et al., 1998)。それまでの7年間、予想もしていなかった困難にぶつかり、悪戦苦闘していたのである。
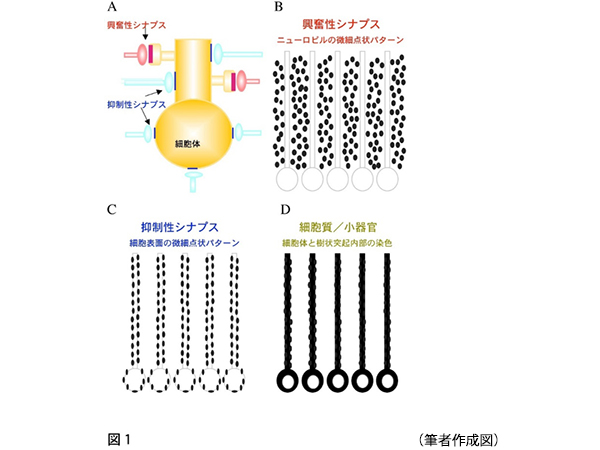
抗体作成を開始した頃は、その特異性検定は、マウス脳タンパク質サンプルを用いたイムノブロット*15でのバンド検出と、免疫組織化学による染色パターンに頼るしかなかった。最初の5年間で、主要な3種のサブユニット(GluN1, GluN2A, GluN2B)のバンドを検出できる5~6種類の抗体ができてきた。私は、3種類の免疫染色パターンを予想していた(図1)。1つ目はイオンチャネル型グルタミン酸受容体などの興奮性シナプス分子の染色パターンのニューロピル*16の点状反応型、2つ目はGABAA受容体などの抑制性シナプス分子の細胞体・樹状突起の表面縁取り型、3つ目が可溶性タンパク質の細胞質型である。情報処理を高度に行う大脳皮質や小脳皮質のニューロンは、興奮性入力を樹状突起上のスパインで受け取って情報処理の個別化を図り、抑制性ニューロンは細胞体や樹状突起幹の表面で受け取る。しかし、4%パラホルムアルデヒド(PFA)固定脳組織を用いて免疫組織化学を実施した結果、作成したすべての抗体は予想したニューロピル型の免疫染色パターンにはならなかったのである。
一方で、米国のWenthold研を皮切りに、欧米の研究室からNMDA型グルタミン酸受容体の酵素抗体法による免疫組織化学論文が次々と発表された(Petralia et al., 1994a, b)。その染色パターンは、全て細胞質型の染色パターンで細胞体や樹状突起幹の内部が強く染色され、スパインが存在する樹状突起幹の間のニューロピルにはほとんど陽性シグナルは見られなかった。そのような写真を見て、ブロットでは特異性がある抗体でも組織化学には向かない抗体なのだと結論して、自身の抗体作成をあきらめず続けることにした。
1995年頃から三品研においてNMDA型グルタミン酸受容体のノックアウトマウスが作成され、その形態学的解析のため輸送されてきた。当時はカルタヘナ条約もなく、遺伝子ノックアウトマウスはペットとして航空機で数千円の費用で自由に輸送できたのどかな時代である。マウスがラボに来てから半年ほど経った頃、GluN2AのノックアウトマウスやGluN2Bヘテロマウスを陰性コントロールとして自作の抗体の特異性検定をすることを思い立った。やってみてわかったことは、通常用いる1µg/mlかそれ以下の抗体濃度では、野生型マウスでもノックアウトマウスでもほとんど染色反応は出てこないこと、Wenthold研の論文で使用している高い濃度による出てくる細胞質型の染色パターンはノックアウトマウスでも同様に出現すること、が判明した。つまり、7年間の奮闘の最初の5年間の努力の結果、通常の検出法では野生型マウスで出現しノックアウトマウスで消失する特異的シグナルを得ることはできないという悲観的な結論に達してしまった。
30代という独立した研究者として成長すべき重要な時期にこのような非生産的な状況に陥り、かなり落胆した。しかし、次第に、NMDA型グルタミン酸受容体の抗体が悪いのではなく、グルタミン酸受容体という分子そのものの性質や有りようが問題ではないのか、と考えるようになった。ちょうどその頃、培養ニューロンのスパイン上のNMDA型グルタミン酸受容体をきれいに染色する論文が報告され、そのDiscussionにこれらの分子の染色にはホルマリン固定よりもメタノール固定やアセトン固定を推奨するという一文を見つけた。これが、それまで一切疑うことがなかった、ホルマリン固定法に疑問を持つキッカケとなった。
次回は、最後の二年間に抗体の浸透とシナプス分子検出のための様々なトライアルを行い、1998年の論文を皮切りに現在まで続けてきた効果的な抗原露出法や抗原賦活法の発掘についてお話しする。
スライドグラスのオートラジオグラフィー
AmershamやKodakという会社名を聞いて、なつかしいと感じるご同輩やご年配の研究者は多いだろう。どちらもすでに消失した会社で、オートラジオグラフィーに不可欠な製品を販売していた。
英国Amersham社のHyperfilm-β maxはマクロオートラジオグラフィー用のX線フィルムで、一方の面だけが感光面の解像度の高いフィルムである。フィルムカセットに洗浄を終えたスライドグラスを敷き詰め、組織切片とフィルムの感光面を向かい合わせ、両者の間に隙間ができないように厚紙などを被せて密着させる。1~3週間の露光の後、暗室で現像と定着を行う。写真投影機にフィルムを載せて拡大し、印画紙に焼き付けて画像データが得られる。
マクロオートラジオグラフィーを終えたスライドグラスは、次に米国Kodak社のNTB-2という感光乳剤を塗布してミクロオートラジオグラフィーを行う。100ml入で10万円もする高価な半固形乳剤で、これを暗室で薬さじを使って乳剤壺(図2)に入れ、同量の水を加えて温浴42度で溶解する。乳剤の泡を丁寧に除去した後に、スライドグラスを乳剤壺に数秒ディップし、壁に立てかけて余分な乳剤を落とし乾燥を待つ。乾燥剤シリカゲルを入れた保管用暗箱にスライドグラス20枚を収納し、ビニールテープでシールして1~2ヶ月間露光する。その後、暗室で現像・定着を行い、必要に応じてヘマトキシリンなどの対比染色を施し、カバーガラスをかけて標本が完成する。写真投影機にスライドグラスを直接載せて印画紙に焼き付けたり、光学顕微鏡で撮影して画像データになる。数百枚のスライドグラスの乳剤塗布は、暗い赤色灯下での数時間の暗室作業となり、日の短い冬であれば暗室から出る頃には日は暮れている。
一連の作業により、in situハイブリダイゼーションからミクロオートラジオグラフィーが終了してデータが得られるまで、半減期の短い33Pを使用しても3ヶ月ほどかかる。研究競争が激しい状況では、毎月新ロットの放射性標識ヌクレオチドが届く度に、前回や前々回の結果を見ずに次の反応を仕込むのが常であった。その成果が、1992年から1994年にかけて発表したNMDA型グルタミン酸受容体の発現解析論文である(Watanabe et al., 1992, 1993, 1994a-e)。
引用文献
用語解説