グルタミン酸を介するシナプス後細胞へ強い脱分極作用から、NMDA型グルタミン酸受容体が発現しているのは、樹状突起スパインのシナプス後部のはずである。しかし、通常の免疫組織化学では、その染色パターンを反映する「ニューロピルの点状反応」は全く得られないことを、前回お話した。今回はその克服法としての抗原露出法と抗原賦活法に焦点を当てる。その前に、シナプスの分類の話から始めたい。
シナプスの分類
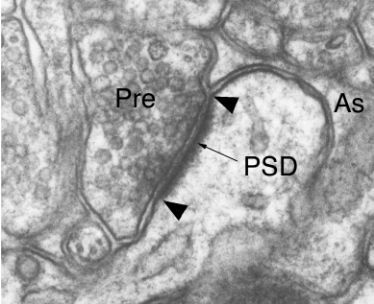
シナプスは、神経伝達物質を充填するシナプス小胞を蓄えたシナプス前部と、受容体が密集するシナプス後部とが、狭いシナプス間隙を挟んで向かい合う化学的情報伝達の接点である。電子顕微鏡が生物学に本格応用され出した頃、ロンドン大学の解剖学者Grayは、シーメンス社の電子顕微鏡を用いてラット大脳皮質を観察し、シナプス後部の厚み(現在、シナプス後膜肥厚postsynaptic density, PSDと呼ばれている)の違いなどに着目して、シナプスを2型に分類した(Gray, 1959)。シナプス前部のそれと比較して、シナプス後部の厚みと密度が非対称的に発達しているシナプスをタイプIと呼び、それらは樹状突起のシャフト上にaxo-dendritic synapseや、スパイン上にaxo-spinous synapseを形成する。また、そのシナプス間隙は30nmとやや広く、間隙の中間帯には分子の集積を思わせるバンドも観察される。これらの特徴は、ニコチン性アセチルコリンを介して興奮性シナプス伝達が行われる神経筋接合部とも、構造的に類似していることに言及している。現代の電子顕微鏡で撮影されるタイプI型シナプス像を図1に示す。
シナプス後部の厚みが薄いタイプIIまたは対称性シナプスは、細胞体上にaxo-somatic synapseや樹状突起のシャフトにaxo-dendritic synapseを形成し、シナプス間隙の中間バンドも不明瞭である。Gray自身はこの2つのタイプに関する機能的な考察はせずに、生理学研究との関連において新たな興味深い特徴であることを述べて論文を終えている。Grayが分類したタイプI(非対称性)、タイプII(対称性)シナプスは、彼の功績をたたえてGray I 型、II型シナプスとも呼ばれる。
一方、電気生理学者は、刺激するとシナプス後部に興奮性シナプス後電位を発生する興奮性シナプスと、抑制性シナプス後電位する抑制性シナプスとに分類していた。シナプスの形態学的分類と機能的分類*1は、分子生物学による神経伝達物質受容体の単離とそのイオン透過性、分子局在解析を経て、中枢神経系におけるタイプI(非対称性)シナプスはグルタミン酸作動性の興奮性シナプスであり、タイプII(対称性)シナプスは主にGABA作動性もしくはグリシン作動性の抑制性シナプスであるという理解が得られた。
興奮性シナプスは抗体浸透を阻害する分子密集地帯
タイプI(非対称性)シナプスの形態学的特殊化から、興奮性シナプスには多くの分子が密集していることは容易に想像できる。1980年代後半からの分子生物学の怒涛の勢いは、まずグルタミン酸受容体の多種類のサブユニットやサブタイプを同定し、受容体と強固に結合してシナプス後部に密集させる足場タンパク質、細胞内情報伝達分子、シナプス間隙を架橋するシナプス接着分子、細胞外に放出されたグルタミン酸を回収するグリア膜上の細胞膜グルタミン酸トランスポーター、細胞質中のグルタミン酸をシナプス小胞に充填する小胞膜グルタミン酸トランスポーターなどの分子を、まさに一網打尽に明らかにした。これらの分子が、図1のような黒々としたシナプス電顕像を作り、神経情報の伝達と制御のための分子ネットワークを構成しているわけである。
この密集した分子環境にホルマリン固定が加わることで、ラッシュアワーの電車の混雑度合いがさらに増して、抗体の浸透と抗原への結合を邪魔しているのであろう。もしそうであるなら、分子密集度を緩和したり、抗体の組織浸透を補助する操作を行えばよいと考えた。1990年代、イオンチャネル型グルタミン酸受容体の免疫組織化学的検出上の問題点に気づき、その解決法に取り組むラボが他にも2つあった。
1つは、イギリスのオックスフォード大学のSomogyiらの研究グループである。彼らは、AMPA型グルタミン酸受容体の検出において、通常の検出ではシナプス外膜やグリア細胞膜上の受容体しか捉えることができないこと、シナプス後部の受容体の検出には抗体の組織浸透操作を省ける包埋後免疫電顕法が不可欠であること、を世界で最初に報告した(Baude et al., 1994, 1995)。後年、そのグループの一員であったNusserは、低濃度ホルマリンやホルマリン溶液のpHの酸性化により、それまで困難であった電位依存性ナトリウムイオンチャネルの樹状突起表面における組織化学検出に成功している(Lorincz et al., 2010)。
2つ目のラボは、スイスのチューリッヒ大学のFritschyのグループで、彼らはNMDA型グルタミン酸受容体とGABAA受容体の検出において、固定せずに取り出した新鮮凍結脳をホルマリン溶液中でマイクロウエーブ照射固定を行うことにより、特異的な検出に成功した(Fritschy et al., 1998)。
次に、私が最初に取り組み、その後私のラボメンバーが継続して取り組んだ、有効な抗原法露出法を紹介する。いずれのラボも、シナプス後部の受容体ならこう染まるはずであるというイメージを予想し、予想と異なる染色結果を受け入れることができずに、納得できるシグナル取得法を追求したという点で共通していた。
有効な抗原露出法
ペプシン処理法が最初の有効な抗原露出法として発表してから(Watanabe et al., 1998)、その後20年に渡って様々な方法にトライしてきた。その中で、分子検出が困難に陥りやすいニューロンの部位が、シナプス後部やシナプス間隙に加え、活動電位発生に関わる軸索初節やランビエ絞輪*2にも共通していることがわかった。これらの特殊な部位に局在する分子検出に有効な5つの方法を、その適用範囲と効果の大きさを加味した5つのカテゴリーの組み合わせとして紹介したい。そのカテゴリーとは、「広く有効」、「時折有効」、「とても有効」、「ある程度有効」、「付加的」である。これらの多くは、実は病理学領域で営々蓄積されてきた抗原露出法・抗原賦活法と呼ばれるものを参照して、最適化を図ったものである。
- 1.ペプシン処理法:光顕レベルでの「広く」「とても」有効な抗原露出法である。
-
タンパク質を検出する免疫組織化学において、タンパク質分解処理が効果的というのは一見パラドックスように感じるかもしれない。しかし、これをやることにより、シナプス、軸索初節*3、ランビエ絞輪の内部にまで抗体が到達するようになり、それまで見られなかったビビッドな強い陽性反応が現れる。様々なプロテアーゼが使用できるが、酸性条件で酵素活性を有し、中性に戻すと酵素活性がなくなるペプシン*4が最もコントロールしやすく使い安い。
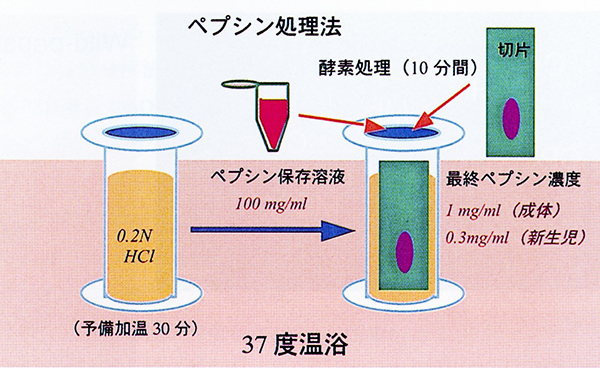
図2にプロトコールの概念図を示す。100mg/mlのペプシン水溶液を1mlずつ分注し冷凍保存しておく。実験時に、温浴で予備加温していた0.2N塩酸水溶液をいれた染色壺にペプシン保存液を加え、スライドグラスに搭載した切片や試験管内に浮遊させた切片を10分間37度でインキュベートする。至適なペプシン最終濃度は、概ね成体組織の場合は1mg/ml、新生児組織の場合は0.3mg/mlである。処理後、PBSに移して酵素処理を停止させ、通常の免疫組織化学のブロッキングから始める。
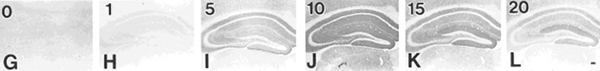
NMDA型グルタミン酸受容体の足場タンパク質の代表格であるPSD-95の検出におけるペプシン処理による効果を図3に示す(Fukaya and Watanabe, 2000)。ペプシン濃度1mg/mlに0分間~20分間の処理により、10分間をピークとした「ニューロピルの点状反応」が現れる。
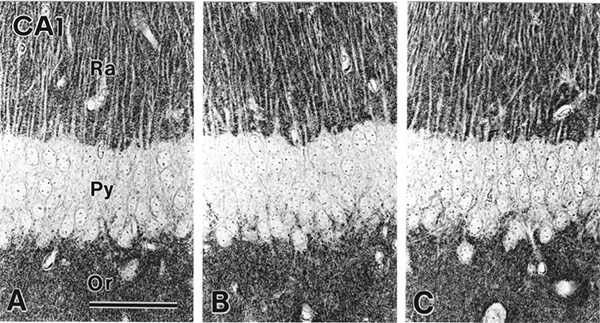
この方法と条件を用いて、NMDA型グルタミン酸受容体GluN2AおよびGluN2Bサブユニットを検出すると(図4)、海馬に最も強く、大脳皮質にも広く反応が見える。このような野生型マウスの脳組織に特徴的な染色パターンは(左)、ノックアウトマウスやヘテロマウスではその反応が消失もしくは著減する(右)ことから、特異的なシグナルを検出していることがわかる(Watanabe et al., 1998)。海馬を高倍率で検鏡すると、細胞体や樹状突起のシャフトの内部はほぼ陰性で、樹状突起と樹状突起の間のニューロピル領域に微細点状反応が密集していることがわかる(図5)。
ペプシン処理法による特異的シグナルの検出は、さまざまなイオンチャネル型受容体とその足場タンパク質、シナプス接着分子、電位依存性イオンチャネルとその足場タンパク質など広範に及ぶ。しかし、タンパク質分解処理した組織は電子顕微鏡では観察できないということが最大の難点である。
- 2.包埋後免疫電顕法:電顕レベルでの「広く」「とても」有効な抗原露出法である。
-
一方、電子顕微鏡レベルでは、上記のような分子を検出するには、最初に固定組織を樹脂に包埋し、ニッケルグリッドに搭載した超薄切片に対して金コロイド標識による免疫反応(包埋後免疫電顕法)が唯一の方法となる。この方法では、抗体の組織浸透のステップが不要になるため透過性問題が解消され、たまたま樹脂表面に露出している抗原を効率よく検出するのである。具体的な方法については、他の成書を参照されたい(Luján and Watanabe, 2021)。
- 3.低濃度ホルマリン固定法:光顕・電顕レベルでの「広く」「ある程度」有効な抗原露出法である。
-
免疫組織化学のためのホルマリン固定といえば、4%のパラフォルムアルデヒド(PFA)溶液で固定することが世界のスタンダードである。しかし、シナプス後部、シナプス間隙、軸索初節、ランビエ絞輪に集積する分子のシグナルは、光顕および電顕レベルとも1%PFAで増強し、超微細構造もよく保たれる。
- 4.新鮮凍結切片法:光顕レベルでの「時折」「とても」有効な抗原露出法である。
-
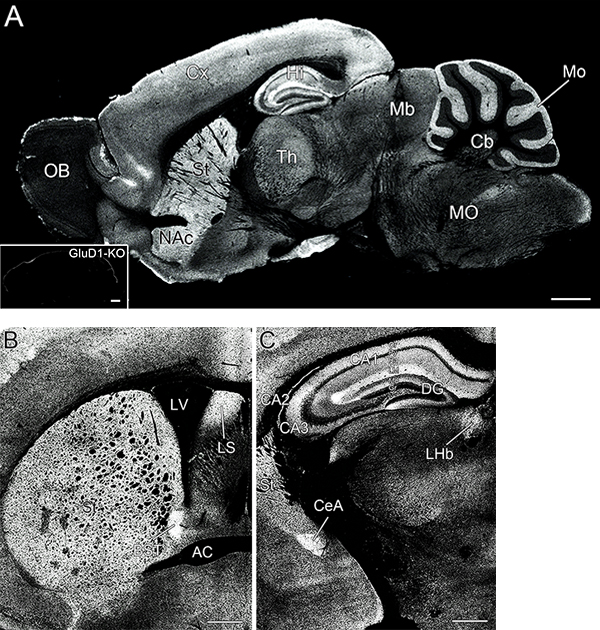
シナプス後部、シナプス間隙、軸索初節、ランビエ絞輪に分布する分子であっても、ペプシン処理や低濃度ホルマリン固定が全く役立たない場合もある。なぜそのようなケースがあることがわかるのかと言えば、新鮮凍結切片が功を奏することがあるからである。その具体的な成功例が、大人では発現していないと思われ長年無視されてきたイオンチャネル型グルタミン酸受容体GluD1で、ペプシン処理法を施しても全くシグナルが得られなかった分子である(図6;Konno et al., 2014)。このような例は数多いとは言えないが、どうしても検出できない場合に試す価値のある窮余の一策または9回裏のサヨナラ代打満塁ホームランである。
新鮮凍結切片とは、ホルマリン固定を行わずに脳組織を新鮮な状態で取り出し、ドライアイス粉末で凍結し、-15度程度のクリオスタット庫内温度で切片を作成しスライドグラスにマウントし、使用時まで超低温フリーザーで保管しておく。免疫組織化学を施行する前に、凍結状態の切片を4%PFA溶液に15分間浸漬定した後に、通常の免疫反応を施す。
- 5.ボイル法:光顕レベルでの「広く」「付加的」な抗原賦活法である。
-
病理学領域ではパラフィン切片を長期間保存するのが一般的で、それによるシグナル低下や切片の劣化がしばしば問題になる。その有効な解決法が、抗原賦活法とよばれるクエン酸バッファーやEDTAバッファーに浸漬したスライドグラスを、オートクレーブや電子レンジなどで加熱して抗原性を復活させる方法である。ボイル法自体には、シナプス後部、シナプス間隙、軸索初節、ランビエ絞輪に分布する分子に対する抗原露出効果はないが、上記1~4の方法と組み合わせるとシグナルが増強する。問題は、加熱後に切片がスライドグラスから脱落したり、ふわふわの剥がれかけた状態になってしまうことである。
この問題を解決する良いボイル法として、私の研究室では日新EM(株)が輸入販売しているイムノセイバー(EDTAバッファー)と、フナコシ(株)から販売されている抗原賦活化装置BIOCARE(温度制御可能な炊飯ジャー)を組み合わせて用いている。200倍希釈したイムノセイバー溶液とスライドグラスを専用の染色ラックにいれ、95度で30分間加熱する。これにより、切片が脱落せずに、シグナルの増強とノイズの低下の両方によるS/N比の改善が得られる。
どの方法が有効かは、検出対象となる分子や抗体の種類によっても変わるため、実験者自身が検討する必要がある。その意味で、「広く」や「とても」とついたカテゴリーはまずトライすべき方法であり、それで十分な満足が得られない場合は、「時折」や「ある程度」や「付加的」な方法も試みるとよい。
引用文献
- Gray EG (1959) Axo-somatic and axo-dendritic synapses of the cerebral cortex, An electron microscope study. J Anat 93:420–433.
- Baude A, Molnár E, Latawiec D, McIlhinney RA, Somogyi P (1994) Synaptic and nonsynaptic localization of the GluR1 subunit of the AMPA-type excitatory amino acid receptor in the rat cerebellum. J Neurosci 14:2830-2843.
- Baude A, Nusser Z., Molnár E, McIlhinney RA, Somogyi P (1995) High-resolution immunogold localization of AMPA type glutamate receptor subunits at synaptic and non-synaptic sites in rat hippocampus. Neuroscience 69:1031-1055.
- Lorincz A, Nusser Z (2010) Molecular identity of dendritic voltage-gated sodium channels. Science 328: 906-909.
- Fritschy JM, Weinmann O, Wenzel A, Benke D (1998) Synapse-specific localization of NMDA and GABA(A) receptor subunits revealed by antigen-retrieval immunohistochemistry. J Comp Neurol 390:194-210.
- Watanabe M, Fukaya M, Sakimura K, Manabe T, Mishina M, Inoue Y (1998) Selective scarcity of NMDA receptor channel subunits in the stratum lucidum (mossy fibre-recipient layer) of the mouse hippocampal CA3 subfield. Eur J Neurosci 10:478-487.
- Luján R, Watanabe M (2021) Post-embedding immunohistochemistry in the localization of receptors and ion channels. In: Receptors and Ion Channel Detection in the Brain. (eds) Luján R, Ciruela F. pp243-265. Humana Press.
- Konno K, Matsuda K, Nakamoto C, Uchigashima M, Miyazaki T, Yamasaki M, Sakimura , Yuzaki M, Watanabe M (2014) Enriched expression of GluD1 in higher brain regions and its involvement in parallel fiber-interneuron synapse formation in the cerebellum. J Neurosci 34:7412-7424.
用語解説
- *1 シナプスの形態学的分類と機能的分類
-
シナプス後膜の肥厚度の違いなどの電子顕微鏡によるシナプス形態の違いに基づく形態学的分類では、タイプI(非対称性)とタイプ2(対称性)に分ける。これに対して、機能的分類では興奮性シナプス後電位を発生する興奮性シナプス、抑制性シナプス後電位を発生する抑制性シナプスに分類する。
これらのシナプス分類の相互関係については、分子生物学による受容体や足場タンパク質の単離と機能解析により明らかになった。イオンチャネル型グルタミン酸受容体はNa+, Ca2+透過性のカチオンチャネルを形成し、陽イオンの流入より脱分極を招く。一方、GABAA受容体やグリシン受容体はCl-透過性のアニオンチャネルを形成し、陰イオンの流入により過分極になる。また、イオンチャネル型グルタミン酸受容体に結合する足場タンパク質には、PSD-95、Shank、Homerなどの様々なクラスの分子があり、それぞれのクラスにも複数のメンバーが存在し、受容体と多様な足場タンパク質の強固な相互結合が非対称性の形態学的基盤となる分厚いPSDを形成する。一方、GABAA受容体やグリシン受容体に結合する抑制性シナプスの足場タンパク質は、ゲフィリン一つが知られるのみである。
- *2 ランビエ絞輪
- 髄鞘と髄鞘の狭い領域をランビエ絞輪とよび、分子環境的にも形態学的にも軸索初節と似ており、活動電位の再生に関わり、跳躍伝導の基盤となる。
- *3 軸索初節 axon initial segment
- 巨大な活動電位が最初に発生するニューロンの部位で、最初の髄鞘が現れるまでの軸索起始部である。ここに電位依存性Na+チャネルや電位依存性K+チャネルがankirinという足場タンパク質を介して密集している。
- *4 ペプシン pepsin
- 胃粘膜の主細胞が産生するタンパク質分解酵素で、胃酸による酸性条件下で前駆体であるペプシノーゲンが自己触媒的に分解され活性型のペプシンとなる。