4.新規固定剤グリオキサールの威力


イオンチャネル型グルタミン酸受容体の検出問題に遭遇し、ペプシン処理法などの問題解決に取り組んだことで、抗体を使うことの難しさと恐ろしさが身にしみてしまった。そのため、私のラボでは、得られた抗体染色像が正しいかどうかをまず疑い、可能な限りその真偽を、遺伝子ノックアウトマウスを陰性コントロールとして確認してきた。遺伝子ノックアウトマウスの入手が困難な場合は、抗体染色像をin situハイブリダイゼーション法による転写物の発現パターンと比較、siRNAによるノックダウン組織でのシグナル低下の確認、抗体の抗原吸収によるシグナル消失、培養細胞の強制発現系による陽性所見の確認など、複数の陰性コントロールと陽性コントロール*1を組み合わせることで、嘘のデータを公表しないよう細心の注意を払ってきた。その甲斐もあり、私の下でスタッフを務めた深谷昌弘(北里大学医学部准教授)、山崎美和子(北海道大学医学部准教授)、宮崎太輔(北海道大学医学部保健学科准教授)、今野幸太郎(北海道大学医学部助教)、内ヶ島基政(新潟大学脳研究所准教授)の5人は、鋭い感性と経験豊富な神経組織化学者として成長した(図1)。しかし、特殊化したニューロン部位に局在する分子検出における抗原露出法・抗原賦活法の必要性への理解は、残念ながら国内的にも国際的にも広がらなかった。
私のメンターである内山安男先生(順天堂大学医学部特任教授)が研究を始めた1970年代は、酵素組織化学*2にせよ免疫組織化学にせよ、固定剤の選択から染色法の手順まで、検出条件の最適化のための予備検討を行うことが常道であり、私もその薫陶を受けた。それが、分子生物学の発展に伴い解析対象となる遺伝子・分子の種類が爆発的に増加すると、免疫組織化学は4%パラホルムアルデヒド(PFA)の固定組織を用いるシンプルなプロトコールとして、それぞれのラボに伝承される画一的なものになっていった。そのような研究環境の中で、経験の浅い学生や若いフタッフにとって自身が得た抗体染色像を疑う必要性を感じるだろうか?それを指導するメンターにもそのような見識と経験がなければ、得られた結果をそのまま無批判的に発表してしまうのではないだろうか?
前回紹介したイオンチャネル型グルタミン酸受容体の免疫組織化学的検出上の問題点に気づいた欧州の研究者の一人であるZoltan Nusserとシチリア島のタオルミーナで会った時に、彼が「世の中のグルタミン酸受容体の組織化学論文や研究発表のほとんどは嘘だよね」と絶望的な状況を憂いていたことを覚えている。世界に向かって警鐘を鳴らしても現実は何も変わらないという半ば諦めの境地になっていたもうすぐ60歳代になるという時に、今回のコラムのテーマであるグリオキサールと出会ったのである。
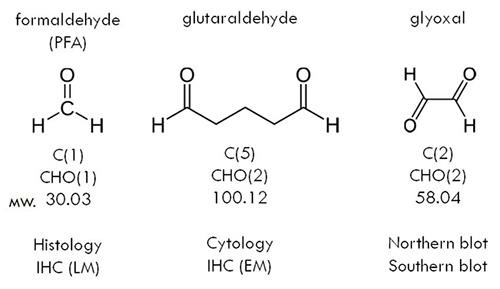
グリオキサールglyoxalは、アルデヒド基(-CHO)を有する化学物質の1つで、その仲間で実験に活用されるものにホルムアルデヒドformaldehyde とグルタールアルデヒドglutaraldehyde(GLA)がある(図2)。
ホルムアルデヒドは、アルデヒド基1個に水素原子が結合した最小のアルデヒド(化学式CH2O、構造式HCHO)で、免疫組織化学やin situハイブリダイゼーションなどの光学顕微鏡レベルの組織化学に用いられる、最も標準的な化学固定剤である。この固定液の実験での使用に際して、2通りの作り方がある。1つはホルムアルデヒドが重合した粉末のPFAを加水分解して4%水溶液として使用するため、「4%PFA」と呼ばれる。もう一つが、38%のホルムアルデヒドを含有したホルマリン溶液を購入し、それを使用時に10倍希釈して用いるため、「10%ホルマリン」と呼ばれる。いずれも、ホルムアルデヒドを約4%含有するという点では同じであるが、作り方の違いにより2通りの呼称で通用している。
一方、電子顕微鏡観察に使用されるもう一つのアルデヒド系固定剤がGLAである。こちらは分子の両端に2つのアルデヒド基を有するジアルデヒドで、その間を3個の炭素原子がリンカーとして繋いでいる(化学式C5H8O2、構造式CHO(CH2)3CHO。この官能基の標的であるアミノ基に結合して分子間の重合を促進するため、GLAは代表的なクロスリンカー*3であり、これが細胞小器官やシナプスなどの超微細構造の保持に役立つと考えられている。一方、GLAは分子の抗原性を著しく低下させることも広く知られている。このため超微細構造の観察用には2%PFA/2%GLAを用い、免疫電顕用には4%PFA/0.1%GLAを使うなど、使用目的に応じてGLA濃度を調節する。
これに対して、グリオキサールは2つのアルデヒド基が背中合わせに結合した、ジアルデヒドとしては最小の分子である(C2H2O2、構造式CHO-CHO)。従来、グリオキサールは、ゲノムDNAやRNAの検出(サザンブロット、ノザンブロット)の際に行われる核酸の電気泳動ゲル用変性剤として使用され、組織化学を目的とした化学固定剤として使用されることはなかった。
組織化学のおけるグリオキサールの有用性を最初に報告したのは、ゲッチンゲン大学のシルビオ・リゾーリSilvio RizzoliのラボからEMBO Journalに出版された2018年の論文、「Glyoxal as an alternative fixative to formaldehyde in immunostaining and super-resolution microscopy(免疫染色および超解像度顕微鏡におけるホルムアルデヒドの代替固定剤としてのグリオキサール)」(Richter et al., 2018)である。彼らは、3%グリオキサール・8%エタノール・0.75%酢酸を混合した固定液と4%PFAを用いて、主に培養細胞におけるシグナル強度の比較から、以下の点を明らかにした。
1.グリオキサール固定液の方が、タンパク質や核酸に対する固定速度、固定力、クロスリンク能が高い。例えば、細胞活動が低下・停止するにつれ細胞内に取り込まれるpropidium iodideやFM1-43の色素取り込み速度を比較すると、グリオキサール固定細胞の方が早く取り込む。この効果はpH依存的で、固定液をpH4-5に調製することが必要である。
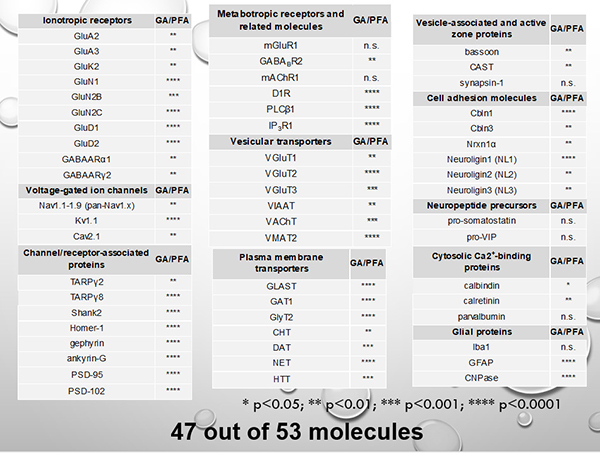
2.最も重要な発見は、多くの分子において蛍光抗体染色の強度が増強することを見出したことである。その効果を、欧米4カ国11の有名ラボにも依頼して、細胞小器官や細胞膜、細胞質などに分布する合計82種類の抗体による蛍光強度を客観的に比較検定した。その結果、グリオキサールの方が勝る抗体が51、4%PFAの方が勝る抗体が12、両者同等が19という結果であった。この中に、シナプス後部分子であるHomer-1とPSD-95に対する3種類の抗体が含まれ、グリオキサールの方が勝る抗体が2つ、両者同等が1つという軍配であった。
抗原露出法・抗原賦活法に長年取り組んできた我々の立場からすると、抗体の浸透が最も阻害されているチャンピオンがNMDA型グルタミン酸受容体とその足場タンパク質PSD-95である。我々は、グリオキサールの方が勝る抗体にPSD-95抗体が含まれていたことに注目し、ラボの今野幸太郎助教を中心として、グリオキサールの可能性を検証することにした。選んだ抗体はNMDA受容体GluN1抗体とPSD-95抗体であり、翌日その威力を早速目にすることになった。4%PFA固定脳組織なら、抗原露出法なしでは全くシグナルが出てこないこれらの分子シグナルが、グリオキサール固定を用いると抗原露出法なしでも容易にシグナルを検出でき、しかもそのシグナル強度が高いのである。その後、6年間の検討結果を重ねて出版した論文のタイトルが、「Glyoxal fixation: An approach to solve immunohistochemical problem in neuroscience research(グリオキサール固定: 神経科学研究における免疫組織化学上の問題を解決するアプローチ」(Konno et al., 2023)である。後日、この論文の査読し評価してくれた3名のレフリーの一人がRizzoli自身であったことを知り、研究という営みを通して生産的なキャッチボールができたことを、心から嬉しく感じた。
主にマウス脳組織切片を用いて明らかにした、この論文の要点を列挙する。
神経科学研究が対象とする神経組織は活発な情報伝達を行うため、シナプス後部、シナプス間隙、軸索初節、ランビエ絞輪などにイオンチャネルが密集し、そこに足場タンパクや補助サブユニットなどの多様な分子群がタイトに相互作用している。従来のホルマリン固定法では、抗原露出法・抗原賦活法が必要な分子と不要な分子を同時に検出しようとすると、得られるシグナルの深度に違いが生じた。例えば、抗原露出法・抗原賦活法が必要なシナプス後部のイオンチャネル型グルタミン酸受容体と、不必要なシナプス前部の小胞膜グルタミン酸輸送体を同時に検出すると、ペプシン処理などで組織表面を削られて露出し検出可能になる受容体のシグナルピークは、輸送体のそれと比べて切片の表面側に位置する。このため、本来はプレシナプスの輸送体とポストシナプスの受容体が向かい合うように検出されるはずなのだが、実際にはなかなか向かい合ってくれないのである。このため、論文に掲載する画像の取得には、字面には記載できないような深い経験と洞察を通して厳選された代表例を掲載しているのである。ところが、グリオキサール固定法により抗原露出法・抗原賦活法の要・不要がなくなると、関連分子がキチンと隣り合ったり、ピッタリと向かい合って検出できるようになった。今後、超解像顕微鏡法*6や膨張顕微鏡法*7などの高解像度イメージングと組み合わせることで、神経科学や細胞生物学の解析精度の向上が期待される。
パラフィンへの包埋過程で組織に加えられる加熱や収縮等により、パラフィン切片を用いた免疫組織化学は凍結切片などを用いるものと比べて、シグナルが低下するのが一般的である。また、長期に渡るパラフィン切片の保存による組織の劣化で、さらに抗原性が低下する。この克服のため、病理学領域ではさまざまな抗原露出法・抗原賦活法が開発され、発展してきたのである。シグナル増強効果がパラフィン切片でも確認でき、霊長類のマーモセット脳組織でも確認でき、抗体の特異性を向上させる効果を考え合わせると、グリオキサール固定法が応用されるべきもう一つの大きな領域が、ヒトパラフィン切片を豊富に抱える病理学研究領域であると考える。これにより、病理診断の精度や信頼性の向上が期待される。
一方、グリオキサール固定には、改善すべき問題点もある。従来のPFAやGLAによる固定組織の電子顕微鏡像では、細胞膜などの脂質二重層が黒く、それ以外の構成成分は白から黒までの間のさまざまな濃淡からなる電子顕微鏡特有のイメージ(これを灰調とよぶ)になる。優れた灰調を備えた電顕写真を撮影し提示できることが、電顕学者の冥利なのである。ところが、グリオキサール固定組織の電子顕微鏡像は膜系のコントラストが増強しすぎて灰調が損なわれ、さらに細胞質中に空白の領域が出現する。分子検出感度が上がるのはよいが、超微細形態像に劣るというのが、現時点でのグリオキサール固定法の最大の難点である。
もう一つの問題点は、固定後の組織が柔らかいことである。これは抗体の組織浸透性が良い特性と表裏一体なのかもしれない。しかし、免疫組織化学の反応中に切片が破れるという実際上の問題がしばしば生じる。特に、脳組織では白質が破損しやすい。原法に比べてグリオキサールと酢酸の濃度をそれぞれ9%と8%に上げた理由が、シグナル損失を防ぎつつ組織硬度を上げることで、切片脆弱性も問題解決の一助とした訳である。
研究者人生の駆け出しの頃に遭遇した大きな困難が、研究者人生の終わり近くになって氷解したという、私にとってはまるで小説「ぽっぽや*8」の主人公・佐藤乙松のような感慨に浸っていることを、ご理解いただけたら幸いである。
引用文献
用語解説